Анонс и статус статьи: статья готова на 75%. Это статья о технологических процессах, происходящих при экстрагировании в системе "жидкость - твердое тело". Конечно же речь пойдет о кофе и всех физических и химических процессах, связанных с его приготовлением.
Читать придется долго. Так что для быстрого погружения в нюансы варки кофе лучше заглянуть сюда:
- статья 1: введение для начинающих
- статья 2: о двух стадиях экстракции кофе
Ну а те, кто хочет почувстовать себя настоящим физиком или химиком, могут продолжить. Небольшое содержание:
- О смесях и растворах
- О массообменных процессах
- Собственно экстракция
- Диффузия - основа экстракции
- ОСМОС и его роль
- Управление экстракцией
- Сложные системы - суспензии, эмульсии, пены
- Расщепление липидов
- Как формируется вкус кофе на рецепторах языка
- Все о кипении
Приготовление кофе основано на понимании следующих весьма и весьма не простых химико-физических процессов:
Рис. 1 - кофе, как трехслойная смесь.
- cушка, экстракция, смачивание, набухание, растворение, диффузия (массообменные процессы);
- простое смешивание веществ;
- получение сложных смесей (коллоидные и дисперсные системы): суспензии, эмульсии, пены;
- расщепление липидов;
- кипение.
Как показано на рисунке справа (рис. 1) - кофе это сложный напиток, состоящий из четырех видов существенно разных по своей физико-химической природе смесей:
- верхний слой: ПЕНА - газ в ЭМУЛЬСИИ
- середина (тело кофе): РАСТВОР
- нижний слой: СУСПЕНЗИЯ (осадок)
Давайте рассмотрим что представляют собой перечисленные выше процессы и образованные в результате их смеси, как эти смеси образуются, на что мы можем и должны влиять, а чего стоит избегать, чтобы не испортить наш напиток.
Примечания:
- настоящий эспрессо состоит на 80% из верхнего слоя.
- кофе, сваренный методом перколяции (например, в кемексе, капельной машине, харио) содержит только средний слой.
- кофе по-турецки всегда содержит гущу/осадок (нижний слой), раствор и пенку (пузырьки воздуха и СО2 в жировой шапке).
0. Начальное отступление
Раз уж мы будем говорить об извлечении кофейного содержимого в воду, давайте сделаем небольшую заметку: крепость кофейного напитка определяется количеством вещества из твердых размолотых частиц (из самих зерен), которое растворились в воде (выделилось в воду) в процессе приготовления напитка. Таким образом, крепость кофе не имеет почти ничего общего с горечью, не связана с содержанием кофеина, не зависит от степени прожаренности использованных зерен, а определяется лишь соотношением воды и кофейного экстракта в вашей чашке. Всё остальное - субъективные ощущения.
Поэтому наша задача - максимально экстрагировать приятные вкусовые и ароматические компоненты из кофейного зерна в воду.
Но ценим мы в напитке не только крепость. Ценим мы также вкус, ощущения плотности, обволакивающую маслянистость пенки и отсутствие крупинок кофе на губах. Давайте посмотрим откуда и что берется...
1. Простые многокомпонентные системы: смеси и растворы
Итак, кофе по-восточному (или по-турецки) - это трехслойный напиток, состоящий их четырех видов смесей: пена, эмульсия, раствор и суспензия. Говоря научным языком, кофе - это сложная многокомпонентная физико-химическая система, каждый компонент которой в свою очередь может быть рассмотрен как система. Начнем с наиболее общих понятий - смесь и раствор.
Смесь — физико-химическая система, в состав которой входят два и более компонент (веществ), молекулы/частицы которых хаотично чередуются друг с другом в пространстве. Смесь описывается составом смеси: качественным и количественным соотношением содержащихся в смесях веществ. Компоненты смеси (или вещества) иногда называют фазами, если хотят подчеркнуть их гомогенность (то есть однородность).
- Если смешать молотый кофе с сахаром, мы получим сухую смесь.
- Если смешать молотый кофе с водой, то мы получим раствор.
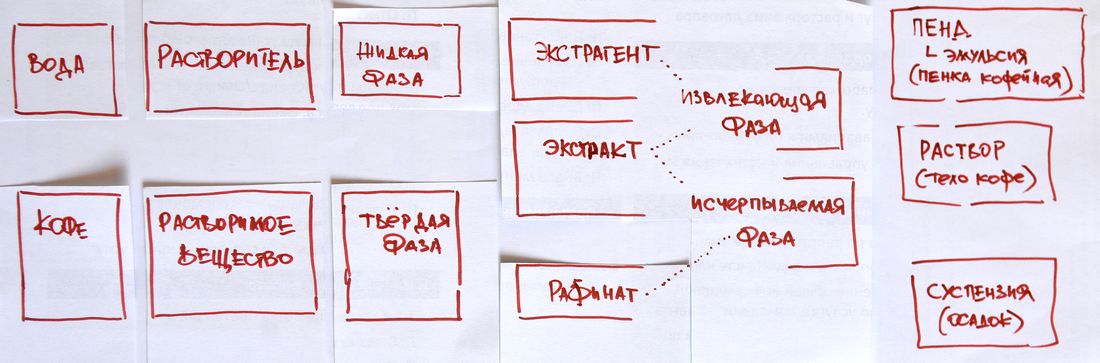 На картинке (в каждой вертикальной паре или тройке):
На картинке (в каждой вертикальной паре или тройке):
несколько вариантов физико-химического представления о кофе на различных стадиях в ходе его приготовления.
Растворение — один из видов массообменного процесса, в ходе которого происходит переход молекул вещества из одной фазы (твердого состояния) в другую (раствор, растворенное состояние). Растворение происходит в результате взаимодействия атомов (молекул) растворителя и растворяемого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда цвет, и другие) меняются.
Раство́р — гомогенная (однородная) смесь (однофазная система), образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия. Компонент, присутствующий в растворе в большем количестве, принято называть растворителем (в нашем случае это вода); растворитель в растворе не меняет своё агрегатное состояние (то есть вода как была, так и остаётся жидкостью в конечном напитке). Остальные компоненты раствора называются растворенными веществами. Для кофе растворенными веществами являются содержащиеся в кофейном зерне углеводы (карамелизированные в ходе обжарки до коричневого цвета), кислоты, жиры, кофеин, микроэлементы и пр.
Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. Таким образом, в процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя качественно новую однородную систему.
Растворение вещества в воде или в органических растворителях сопровождается образованием малопрочных соединений молекул этого вещества с молекулами растворителя. Если растворителем является вода, то в растворе образуются гидраты, а если растворителем является органический растворитель, то в растворах образуются сольваты молекул растворенного вещества. Гидраты и сольваты молекул являются малопрочными.
Образование химических связей между частицами растворяемого вещества и растворителя в общем случае называется сольватацией, а если растворителем является вода, то процесс связывания воды с частицами твердой фазы называется гидратацией.
Таким образом, растворение – это физико-химический процесс, так как при растворении протекают как физические процессы (диффузия), так и химические - сольватация и гидратация.
Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с образованием новых соединений. Исходные вещества (компоненты) входят в смесь (раствор) неизменными и остаются таковыми на всем протяжении существования смеси: при смешивании не возникает никакое новое вещество, хотя при этом исходные вещества могут стать неузнаваемыми, потому что смесь обнаруживает другие физические свойства по сравнению с каждым изолированным исходным веществом. Специфические качества смеси, например, плотность, цвет или температура кипения для растворов, зависят от соотношения компонентов смеси (соотношения по массе).
Растворы не отстаиваются и сохраняются все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни марганцевокислый калий не удается отделить от воды. Следовательно, эти вещества в воде раздроблены до наиболее мелких частиц – молекул. Молекулы могут опять собраться в кристаллы только тогда, когда мы выпарим воду. Таким образом, растворы – это молекулярные смеси.
По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными. Так, воздух – это газообразный раствор, гомогенная смесь газов; водка – жидкий раствор: смесь нескольких веществ, образующих одну жидкую фазу; морская вода – жидкий раствор: смесь твердого (соль) и жидкого (вода) веществ, образующих одну жидкую фазу; латунь – твердый раствор: смесь двух твердых веществ (меди и цинка), образующих одну твердую фазу.
Давайте рассмотрим, как происходит растворение веществ, например, сахара в воде. Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды донорно-акцепторные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды (происходит гидратация молекул сахара). Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от поверхности кристалла и переходить в толщу молекул растворителя (в глубь жидкой фазы): свободные молекулы воды разгоняются в тепловом потоке и буквально сталкивают с поверхности кристалла гидратированные молекулы сахара.
Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называется диффузией. Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора. Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
1.1. О ВОДЕ
Вода - один из самых распространенных растворителей на земле.
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов, взаимодействует с активными металлами, участвует в реакциях превращения белков, липидов, углеводов. При добавлении различных веществ к воде изменяются свойства как самого вещества, так и воды. С заряженными ионами металлов и кислот вода прочно связывается ионными связями. С нейтральными, но полярными молекулами (спирты, амины, альдегиды, кетоны) вода связывается водородными связями (более слабые, чем ионные связи). С неполярными веществами (углеводороды) вода химически не взаимодействует, но образует вокруг них сетку из молекул воды.
Вода обладает исключительно большим поверхностным натяжением. Сила молекулярного притяжения между молекулами воды аномально велика по сравнению с другими жидкостями. Поэтому каждая молекула втягивается с поверхности внутрь жидкости. Возникает сила, стягивающая поверхность. Сила поверхностного натяжения воды - максимальна среди всех известных жидкостей. Эта сила и придаёт мыльному пузырю, падающей капле и любому количеству жидкости в условиях невесомости форму шара. Она поддерживает бегающих по поверхности пруда жуков, лапки которых водой не смачиваются. А стенки тонких пор и отверстий, наоборот, хорошо смачиваются водой.
Под кислотностью воды понимают содержание в ней положительных ионов водорода H+ (появляющихся вследствие разложения молекул воды на ионы H+ и OH-), которые способны вступать в химическую реакцию. Химики измеряют содержание этих ионов в воде в молях на литр и называют его водородным показателем (pondus Hydrogenii).
рН воды для кофе должен быть от 6,5 до 7,5. Оптимальный вариант - 7. Чистая вода должна иметь нейтральный рН 7. С дополнительными ионами водорода (H +) рН воды возрастает, что означает, что она имеет более высокую кислотность. Наоборот, при высоком присутствии гидроксид ионов (ОН - ) вода может приобрести горький вкус. И в том, и в другом случае вкус чашки кофе может существенно измениться. Как правило, если для варки кофе используется вода со слишком большим уровнем рН, вкус получается слишком «плоским».
Небольшое отступление (можно пропустить).
==== врезка ===============
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ.
Иногда бывает трудно провести грань между физическим перемешиванием веществ и их химическим взаимодействием. Например, при смешивании газообразного хлороводорода HCl с водой H2O образуются ионы H3O+ и Cl–. Они притягивают к себе соседние молекулы воды, образуя гидраты (гидратами называются соединения, образованные в результате химического взаимодействие растворенного вещества с водой). Таким образом, исходные компоненты – HCl и H2O – после смешивания претерпевают существенные изменения. Тем не менее ионизация и гидратация (или в общем случае – сольватация, как писалось выше) часто рассматриваются как физические процессы, происходящие при образовании растворов.
Истинные (молекулярный) растворы - это одна из разновидностей растворов, в которой размеры частиц растворенного вещества предельно малы и сопоставимы с размером частиц растворителя. В истинных растворах растворенное вещество раздроблено до отдельных молекул, ионов или атомов.
Истинные растворы - однородные ( гомогенные) системы, так как между распределенным веществом и средой отсутствует поверхность раздела. Тело кофе - истинный раствор.
Истинные растворы, представляющие собой полностью однородные системы, всегда следует отличать от коллоидных растворов - одного из видов дисперсных систем, обладающих микрогетерогенностью. Истинные растворы в отличие от коллоидных представляют собой гомогенные ( однофазные) системы, коллоидные растворы - гетерогенные системы, содержащие две фазы - коллоидные частицы и дисперсионную среду. Истинные растворы при наличии у растворяемого вещества сродства с растворителем образуются самопроизвольно. Истинные растворы находятся в термодинамическом равновесии и могут храниться очень долго, коллоидные растворы способны стареть.
Истинные растворы бывают насыщенные, ненасыщенные и пересыщенные.
Два вещества (компонента), растворяющиеся друг в друге в любых пропорциях с образованием истинных растворов, называют полностью взаиморастворимыми. Такими веществами являются все газы и многие жидкости (например, этиловый спирт + вода = водка).
Если два компонента образуют одну фазу при смешивании только в определенных пропорциях, а в других случаях возникают две фазы, то они называются частично взаиморастворимыми. Если два компонента (вещества) лишь частично взаиморастворимы, то при данных температуре и давлении существует предельное количество одного вещества, которое способно образовать истинный раствор с другим в равновесных условиях. Раствор с предельной концентрацией растворенного вещества называют насыщенным. Можно приготовить и так называемый пересыщенный раствор, в котором концентрация растворенного вещества даже больше, чем в насыщенном. Однако пересыщенные растворы неустойчивы, и при малейшем изменении условий, например при перемешивании, попадании частичек пыли или добавлении кристалликов растворяемого вещества, избыток растворенного вещества выпадает в осадок.
Концентрация раствора – это величина, отражающая пропорции между растворенным веществом и растворителем. Такие качественные понятия, как «разбавленный» и «концентрированный», говорят только о том, что раствор содержит мало или много растворенного вещества. Для количественного выражения концентрации растворов часто используют проценты (массовые или объемные), а в научной литературе – число молей или химических эквивалентов растворенного вещества на единицу массы или объема растворителя либо раствора.
КОНЦЕНТРАЦИЯ (новолат. concentratio - сосредоточение), отношение числа частиц компонента системы (смеси, раствора, сплава), его количества (молярная концентрация) или массы (массовая концентрация) к объему системы
Растворимость вещества – это его способность образовывать растворы с другими веществами. Количественно растворимость газа, жидкости или твердого тела измеряется концентрацией их насыщенного раствора при данной температуре. Это важная характеристика вещества, помогающая понять его природу, а также влиять на ход реакций, в которых это вещество участвует. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Растворимость твердых веществ в жидком экстрагенте зависит от: структуры (пористости) твердого вещества, проникающей способности экстрагентов в клетки твердого вещества, степени его измельчения, интенсивности перемешивания смеси измельченного вещества и экстрагента, кратности настаивания вещества с экстрагеитом, температуры, рН среды и ряда других факторов.
==== конец врезки ==========
Кофе и чай - примеры ненасыщенных растворов.
Итак, если кофе, как напиток (готовый напиток), это раствор, то процесс перехода содержимого кофейных зерен в воду называется растворение. Однако для приготовления кофе подойдет более узкий термин - экстракция. Экстракция - это выделение / вытягивание содержимого кофейного зерна в воду. Пока из кофейного зерна не вышло основное его содержимое, мы не получим наш трехслойных напиток (см. рис.1).
2. Экстракция кофе.
2.0. МАССООБМЕННЫЕ ПРОЦЕССЫ
МАССООБМEН - необратимый перенос массы вещества, входящего в смесь, в пределах одной или нескольких фаз смеси. Массообмен осуществляется в результате:
- молекулярной диффузии - хаотического движения молекул, которое осуществляется без видимого перемещения участков фазы и обусловлено тепловым движением молекул,
- макроскопичического движения всей среды (конвективный перенос),
- хаотического движения вихрей различного размера (в турбулентных потоках).
Массообмен включает массоотдачу (перенос вещества от границы раздела в глубь фазы) и массопередачу (перенос вещества из одной фазы в другую через поверхность раздела фаз). Массообмен лежит в основе разнообразных процессов, объединяемых в класс массообменных. Многие тепловые процессы, такие как прокаливание, конденсация, выпаривание, испарение, перемешивание - сопровождаются массообменом. В большинстве случаев в массообмене участвуют две или более фаз, в которых концентрации целевого компонента при равновесии различаются. При взаимодействии двух фаз в соответствии со вторым началом термодинамики их состояние изменяется в направлении достижения равновесия, которое характеризуется равенством температур и давлений фаз, а также равенством химических потенциалов каждого компонента в сосуществующих фазах. Движущая сила переноса какого-либо компонента из одной фазы в другую - разность химических потенциалов этого компонента во взаимодействующих фазах. Переход компонента происходит в направлении убывания его химического потенциала. Массообмен (для кофе) осуществляется также под действием градиента температуры. Движущая сила массообмена пропорциональна градиенту концентрации (см далее - гидромодуль).
Условия контактирования фаз в процессах массообмена исключительно разнообразны. Так, при дистилляции в непосредств. контакте находятся насыщенный пар и кипящая жидкость, что способствует переносу менее летучих компонентов из пара в жидкость и более летучих - из жидкости в пар. В процессах адсорбции газовая или жидкая смесь разделяется в результате предпочтительной сорбции одного из компонентов на пов-сти твердого адсорбента. Кристаллизацию используют для выделения кристаллизующейся твердой фазы из раствора путем создания условий пересыщения по нужному компоненту. Операции сушки зависят от переноса как жидкости, так и пара внутри твердого тела и затем пара в осушающий газ. Все эти процессы, а также ионный обмен, сублимация и др. объединяются общими кинетич. закономерностями, определяющими скорость межфазного переноса массы. Последняя зависит от:
- скорости молекулярной диффузии в неподвижной среде
- скорости конвективной диффузии в движущейся среде,
- от специфичических условий на границе раздела фаз.
Конвективная диффузия.
Перенос вещества в движущейся среде обусловлен двумя различными механизмами:
- наличие разности концентраций в жидкости вызывает молекулярную диффузию;
- частицы вещества, растворенного в жидкости, увлекаются последней при ее движении и переносятся вместе с ней.
Совокупность обоих процессов называется конвективной диффузией.
2.1. ХИМИЧЕСКАЯ КИНЕТИКА
Влияние разных факторов, условий и параметров на скорость химических и биохимических преобразований в кулинарии называется химической кинетикой, которая характеризуется изменением концентрации одного из реагирующих веществ за единицу времени. При расчетах скорости реакции следует рассматривать одно или несколько из исходных (начальных) веществ, концентрация которых в процессе химических и биохимических преобразований увеличивается или уменьшается.
Основными факторами, которые влияют на скорость всех химических и биохимических реакций при переработке пищевого сырья, являются:
- концентрация реагирующих веществ,
- температура
- присутствие катализатора (ферментов и др.).
1. Увеличение концентрации взаимодействующих веществ — один из наиболее универсальных приемов интенсификации технологических процессов в пищевой промышленности.
2. Температура —определяет скорость химических и биохимических реакций в пищевых технологиях. Влияние температуры и концентрации реагирующих веществ на скорость реакций объясняется теорией активных столкновений, согласно которой химическое взаимодействие между молекулами разных компонентов возможно только при эффективном их столкновении. Т.е., в химическую реакцию вступают только те молекулы, которые имеют соответствующую энергию. Молекулы, которые имеют такую энергию, называются активными. Избыточная энергия молекул называется энергией активации и зависит как от природы вступающих в реакцию веществ, так и от температуры среды. Для протекания химических и биохимических реакций в пищевых технологиях необходимо разорвать межмолекулярные связи реагирующих веществ. Если при столкновении молекулы имеют большую энергию и ее достаточно для разрыва связей, тогда химическая реакция произойдет, а если энергия молекул будет меньше необходимой, то столкновение будет неэффективным и реакция не наступит. При повышении температуры среды количество активных молекул увеличивается и одновременно увеличивается число столкновений между ними, в результате возрастает скорость химических реакций. При увеличении концентрации реагирующих веществ общее число эффективных столкновений молекул также увеличивается, как следствие — скорость реакции увеличивается.
3. Большое значение для ускорения химических и биохимических реакций имеет катализатор. Его присутствие в пищевом сырье, которое перерабатывается на продукты питания, ускоряет реакции в тысячи раз. В пищевых технологиях большое количество гомогенных реакций катализируются действием ионов. К таким реакциям относятся инверсия сахарозы, гидролиз сложных эфиров, в том числе жиров.
Ионы металлов катализируют реакции окисления и гидролиза. Например, ионы меди катализируют окисление аскорбиновой кислоты, а потому оборудование и аппараты для переработки плодов, ягод и овощей не следует изготавлять из меди и ее сплавов.
Окисление пищевых жиров ускоряется под действием ионов железа, меди, марганца, а потому жир не нужно хранить в металлической таре.
Большинство каталитических реакций в присутствии катализатора носят положительный характер, т. е. такой катализатор значительно ускоряет химические и биохимические реакции.
Все биохимические и биотехнологические процессы в пищевых технологиях происходят при помощи ферментов — биологически активных естественных катализаторов белкового происхождения. Наиболее интенсивное влияние на активность ферментов и скорость биохимических процессов в пищевом сырье имеют температура и реакция среды.
С повышением температуры активность ферментов возрастает и достигает максимума при оптимальной температуре для каждого отдельно взятого фермента. Температурный оптимум для ферментов растительного происхождения составляет около 40...50° С. Все ферменты как естественные катализаторы ускоряют реакции в биотехнологических процессах пищевых технологий в 100 (сотни) раз. Это намного больше, чем активность химических катализаторов.
Снижение активности фермента при повышении температуры связано с процессами денатурации белка, так как фермент — это органический естественный катализатор белкового происхождения. Полное прекращение действия фермента происходит при температурах, близких к 100° С, что однако не имеет отношения к термофильным ферментам, которые выдерживают короткое нагревание, равное температуре выше 100° С.
Кроме того, каждый фермент проявляет свою активность в соответствующих границах значения pH.
2.2. НАБУХАНИЕ
НАБУХАНИЕ - увеличение объема (массы) кофейных частичек (в том числе белков, углеводов и других микроэлементов) в результате поглощения жидкости при сохранении ими свойства нетекучести (т.е. форма кофейных частичек не изменяется). Характеризуется степенью набухания - отношением объема (массы) набухшего вещества к его исходному объему (массе). Степень набухания увеличивается во времени, постепенно приближаясь к равновесному значению. Степень набухания зависит от структуры твердой фазы и может колебаться от 2-3-кратного объема до десятков раз (превышение в десятки раз от исходной сухой твердой массы).
Кинетика набухания определяется сродством жидкости к веществам твердого тела (компонентам твердой фазы) и скоростью диффузионных процессов. В пористых телах набухание ускоряется в результате капиллярного проникновения в них жидкости. Набухание в жидкостях, неограниченно совместимых с твердыми веществами, приводит к полному растворению вещества с переходом его в вязкотекучее состояние.
Набуханию предшествует смачивание. И набухание, и смачивание - всё это виды гидратации. Молекулы воды связываются с молекулами кофейных компонент рыхлят их, отдаляют друг от друга, снижают межмолекулярные связи. Набухание клетчатки повышает ее эластичность и гибкость (то есть меняет ее упругие свойства). В результате этого кофейные молекулы (жиры, углеводы, белки, микроэлементы и пр) легко и свободно переходят в раствор. Таким образом происходит растворение кофе или его экстракция.
Смачивание выражается в пропитывании водой пористых тел, в проникновении жидкости в капиллярно-пористые тела и как следствие адгезии жидкости к определённой поверхности. Чтобы смачивание происходило, необходимо, чтобы молекулы воды притягивались друг к другу слабее, чем к молекулам твёрдого тела. Смачивание пока не описано в данной статье. Изучение смачивания важно при варке кофе крупного помола. Очевидно также, что чем крупнее помол, тем больше клеточные структуры кофе препятсвуют диффузии молекул твердного тела в жидкость (см далее о диффузии).
2.3. СОБСТВЕННО ЭКСТРАКЦИЯ
Приготовление всех видов кофе основано на экстрагировании или экстракции (от лат. extraho – вытягиваю, извлекаю) вкусовых и ароматических веществ в системе из двух компонент: “жидкость + твёрдое тело”. Жидкой фазой (1-й компонент системы) служит вода, а измельчённые зёрна кофе (2-й компонент) – это твердое тело. Движущая сила процесса экстракции – разность концентраций между экстрагентом (вода) и молотым кофе. Экстракт — это готовый кофе.
Экстрагирование — разделение неоднородной системы типа Т—Г (твердое тело — газ) путем извлечения из сложного по составу вещества одного или нескольких компонентов с помощью растворителя (экстрагента), обладающего избирательным действием. Этот процесс осуществляется в экстракторах (например, в турке). В случае, если смесь веществ, из которой извлекается один или несколько компонентов, является жидкой, разделяемая система становится однородной и термин «экстрагирование» заменяется термином «экстракция».
Экстракция - метод извлечения вещества из сухой смеси твердого тела (здесь: молотые кофейные зерна) с помощью подходящего растворителя - экстраге́нта (вода). То есть вода является как средством извлечения, так и основной составляющей результирующего раствора. Экстракция может быть:
- разовой (гейзерная кофеварка или эспрессо-машина),
- многократной (особые виды кофеварок с перекидной трубкой или варение мырры у турков),
непрерывной, например, заваривание кофе во френч-пресс или в джезве.
Экстракция методом просачивания жидкости сквозь твердое тело растворимого вещества называется перколя́ция (от лат. percōlāre, просачиваться, протекать). Отсюда и слово - перколятор.
В ходе экстрагирования последовательно протекают четыре простых процесса:
- проникновение растворителя в поры частиц сырья;
- растворение извлекаемого компонента;
- перенос его внутри частицы к ее поверхности;
- перенос от поверхности вещества в объем экстрагента.
В конкретных случаях отдельные процессы могут отсутствовать или не играть существенной роли. В частности, две первые стадии процесса могут протекать быстро по сравнению с двумя вторыми и потому их можно не учитывать при анализе динамики процесса.
Жидкостная экстракция предполагает перенос одного (или больше) растворимых веществ в жидкость (экстрагент). Экстрагент, обогащенный растворимыми веществами, называется экстракт (или извлекающая фаза). Если растворимые вещества сами по себе в исходном состоянии представляют собой смесь (или раствор), то остаток исходного раствора, освобожденный от растворимых веществ, называется рафинат (исчерпываемая фаза). Условно к рафинату можно отнести жмых (кофейный осадок, пребывающий во взвешенном состоянии). Примечание: в ряде методов варки по-восточному используется как раз такая двухступенчатая экстракция, когда кофе варят в небольшом объеме, получая его концентрированный раствор, а потом доваривают кофе в бо́льшем количестве воды.
Исходную смесь (молотый кофе) и экстрагент соединяют друг с другом для того, чтобы осуществился перенос растворимых веществ в раствор. Сначала эта смесь имеет свойства и вид суспензии: взвешенные частички кофе плавают в воде. Но постепенно твердые частички кофе размягчаются (намокают) и отдают свои растворимые вещества в воду. В результате мы имеем казалось бы одну однородную фазу. Однако для кофе, как впрочем и в результате растворения в ряде других случаев, на выходе получают не одну, а две жидкие фазы: экстракт и рафинат, как например, раствор кофе и кофейный осадок. И часто может потребоваться их разделение. Разделение может выполняться самыми разными способами, что зависит от природы фаз. Примеры процессов разделения - это статическая декантация (в смеситель-отстойниках) или центробежная декантация (в центробежных экстракторах). В случае с туркой отделение раствора от осадка происходит путем отстаивания напитка и его перелива. В сущности осаждение осадка (гущи) происходит сразу же по факту прекращения подачи тепла к турке. Помогают также:
- резкое постукивание туркой по столу
- добавление в готовый кофе чайно ложки холодной воды
- слив готового напитка в чашку.
Для разделения эмульсий используют отстойники, для трудноразделимых эмульсий – сепараторы. Иногда используют многоступенчатую экстракцию, которая проводится в многосекционных экстракторах или экстракционных установках, в том числе с противотоком экстрагента или комбинированным способом при наличии нескольких экстрагентов. Многоступенчатая противоточная экстракция более эффективна, чем экстракция в перекрестном токе. При противоточной экстракции достигается более высокая средняя движущая сила процесса и происходит более полное извлечение компонента из раствора. Примечание: нечто подобное происходит при производстве растворимого кофе.
2.4. ДИФФУЗИЯ
Диффузия, как физическое явление, лежит в основе процесса экстракции.
Диффузия - (лат. diffusio — распространение, рассеивание) - распространение молекул или атомов одного вещества между молекулами или атомами другого, приводящее к самопроизвольному выравниванию их концентраций по всему занимаемому объёму. Диффузия основана на случайном характере движения отдельных молекул, однако перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (вдоль вектора градиента концентрации). С молекулярно-кинетической точки зрения диффузия является следствием теплового движения частиц растворенного вещества.
Примером диффузии может служить перемешивание газов (например, распространение запахов) или перемешивание жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Еще один пример: если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, если медь покрыть золотом, то будет происходить диффузия золота в медь, но при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет. Другой пример: на золотой слиток был положен слиток свинца, и под грузом за пять лет свинцовый слиток проник в золотой слиток на сантиметр.
Диффузия представляет собой процесс на молекулярном уровне. Все виды диффузии подчиняются одним законам: скорость диффузии пропорциональна площади соприкосновения взаимодействующих компонент, а также разности их концентраций и температур. То есть чем мельче помол, чем горячее вода и чем меньше кофе мы положим в воду, тем быстрее будет протекать диффузия.
Для повышения скорости диффузии (скорость диффузии пропорциональна средней скорости молекул) и стало быть экстракции требуется повышение температуры раствора и постоянное перемешивание или столкновение фаз (компонентов, веществ) исходного раствора. Такое перемешивание может достигаться турбуляцией, встряской, распылением, пульсацией и т.п.
При приготовлении кофе следует различать два вида диффузии, внутренняя и внешняя:
- внутренняя диффузия - переход экстрагируемого компонента из внутренних слоев к наружным;
- внешняя диффузия - переход экстрагируемого компонента от поверхности твёрдого тела в жидкость.
Примечание по внутренней диффузии: чем крупнее помол, тем сильнее клеточная струкура (оболочки, клетчатка) влияет на задержку выхода экстрагируемого компонента в раствор.
Примечание по внешней диффузии: перемешивании дисперсионной среды вокруг кофе (в том числе и путем встряхивания) выравнивает концентрацию экстрагируемого вещества в дисперсионной среде, что увеличивает градиент концентрации экстрагируемого вещества вблизи твердой поверхности кофе и этим интенсифицирует процесс экстракции в целом.
Если привести в соприкосновение два раствора с разными концентрациями, то молекулы будут диффундировать преимущественно в том направлении, где их концентрация ниже. Двусторонняя диффузия приведет к выравниванию концентраций.
Молекулярная диффузия сопровождается осмотическим переносом, который представляет собой встречное перемещение растворителя ( воды), равное диффузионному по величине и противоположное по направлению. Иногда диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя. Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом.
Молекулярная диффузия обычно мала по сравнению с конвективным переносом веществ или благодаря их турбулентному движению. По этой причине нужно либо турку нагревать с боков (для обеспечения нужных конвективных потоков), либо помешивать кофе в ходе его вываривания (экстрагирования).
Причина возникновения концентрационной диффузии и осмоса одна и та же — выравнивание концентрации. Однако способы выравнивания резко отличаются друг от друга.
2.5. ОСМОС
Прим: подраздел пока не готов. Может он и лишний? - пропустите пока.
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества. То есть это проникновение воды в кофе.
Диффузия осуществляется перемещением растворенного вещества, а осмос — перемещением молекул растворителя и возникает при наличии полупроницаемой перегородки. Этой перегородкой в растительных и животных клетках служит мембрана.
В кулинарной практике явление осмоса наблюдается при замачивании подвядших корнеплодов, клубней картофеля, корней хрена с целью облегчения очистки, снижения количества отходов. При замачивании овощей вода поступает внутрь клетки до наступления концентрационного равновесия, объем раствора в клетке увеличивается, возникает избыточное давление, называемое осмотическим или тургором. Тургор придает овощам и другим продуктам прочность, упругость.
Если поместить овощи или фрукты в раствор с высокой концентрацией сахара или соли, то наблюдается явление, обратное осмосу, — плазмолиз. Оно заключается в обезвоживании клеток и имеет место при консервировании плодов и овощей, при квашении капусты, солении огурцов и др. Отчасти этим объясняется почему кофе, сваренный в сладкой воде (или слегка подсоленный) будет крепче, чем кофе, сваренный без сахара.
При плазмолизе осмотическое давление внешнего раствора больше, чем давление внутри клетки. В результате происходит выделение клеточного сока. Аналогичным образом происходит вытягивание из набухшего в воде кофейного зерна гидратированных микрочастиц кофе.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворяемых веществ. Как правило, это связано с размерами и подвижностью молекул растворителя, в частности молекула воды меньше большинства молекул растворяемых веществ. Частички кофе и воду разделяют мембраны кофейного зерна. Концентрация воды (остаточная влажность) в кофейных частичках гораздо ниже, чем в самой воде, так как внутри кофейного зерна преобладают соли, масла, белки, углеводы и микроэлементы. Вследствие этого, переходы частиц растворителя (воды) внутрь зерна будут происходить чаще, чем в противоположном направлении. Соответственно, зерно будет быстрее набухать, а его микроэлементы - увеличивать подвижность и выходить наружу в раствор, окрашивая его приятным шоколадным цветом (цвет карамелизированных углеводов). Чтобы стимулировать процесс осмоса кофейные зерна желательно подсушить перед размолом.
Примечание: в мертвых клетках мембрана не обладает полупроницаемостью, не контролирует потоки веществ, и осмотический выход воды не происходит.
Перенос растворителя через мембрану обусловлен осмотическим давлением.
Осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выровнять концентрацию раствора в обеих средах, разделенных мембраной (то есть внутри зерна и вне его), и описывается вторым законом термодинамики. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов (внутри зерна и вне его) вследствие встречной диффузии молекул растворённого вещества и растворителя.
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим. Гипертонические растворы, такие как раствор сахара (сироп) или раствор соли (рассол) широко применяются для консервирования продуктов, т.к. вызывают удаление воды из овощей или фруктов. При этом сами овощи и фрукты насыщаются солью или сахаром. Высокие концентрации соли и сахара в отсутствие воды предохраняют овощи и фрукты от развития в них различных бактерий, что и приводит к высокой сохранности засоленых или засахаренных продуктов.
Каждая клетка или живой организм обладает определенных осмотическим потенциалом. На величину осмотического потенциала влияет концентрация растворенных веществ в клеточном соке — это осмотически активные вещества (органические кислоты, соли, аминокислоты, сахара). Растение в определенной степени регулирует величину осмотического потенциала. Ферментативное превращение сложных нерастворимых веществ в растворимые (крахмала в сахара, белков в аминокислоты) приводит к возрастанию концентрации клеточного сока и повышению величины осмотического потенциала. Увеличенное накопление растворимых солей также повышает осмотический потенциал. Несмотря на то, что осмотический потенциал меняется в зависимости от внешних условий, все же для каждого вида клеток эти изменения происходят в своих определенных пределах. Величину осмотического потенциала многие физиологи считают одной из характеристик данного вида растений.
2.6. КОФЕ: УПРАВЛЯЕМ ЭКСТРАКЦИЕЙ
Применительно к кофе на эффективность (скорость и полноту) процесса экстракции влияет совокупность следующих факторов (приводится в приблизительном порядке от наиболее сильных факторов к слабым):
- температура воды. Наибольшая скорость экстракции - в диапазоне от 85 до 95°С
- обжарка (именно обжарка делает содержимое кофейного зерна способным к растворению в воде. Если не верите, попробуйте сварить зеленый кофе)
- продолжительность процесса экстрагирования (настаивания)
- степень помола или размер частиц молотого кофе: чем меньше помол, тем выше скорость экстракции
- частота и интенсивность турбулизации (перемешивания) растворителя (дисперсионной среды) вокруг твердых частиц, из которых экстрагируется продукт (перемишвание среды “молотый кофе – вода”).
- величина движущей силы процесса, которая зависит от соотношения массы молотого кофе и количества воды: гидромодуль. Гидромодуль для кофе по-восточному можно указать так: 7 граммов кофе на 80-150 мл воды.
- сорт и состав кофейных зёрен (например, их плотность или рыхлость)
- вода (химический и механический состав).
... где гидромодуль - это отношение общего объема жидкости в процессе варки к массе сухого кофе. В зависимости от величины гидромодуля различают варку, пассировку, тушение, жарение и т.п.
Немного теории о помоле: уменьшение кофейных частиц существенно ускоряет экстрагирование. Однако при малых размерах частиц возможно их «слипание» и в результате эффективная поверхность соприкосновении с экстрагентом может уменьшиться до 20…25 % и менее от полной внешней площади поверхности частиц. В значительной мере предотвращению неблагоприятного воздействия «слипания» способствует перемешивание частиц различными способами, включая низкочастотные механические колебании, организацию процесса в кипящем слое, ультразвуковые колебания, электроимпульсные воздействия, периодический отжим продукта. Для предотвращения слипания следует также повышать гидромодуль.
Когда кофе подобран, размолот и залит водой, влиять на экстракцию можно только за счет двух факторов: температура (в том числе скорость нагрева), и турбулизация раствора. От температуры будет зависеть скорость внутренней диффузии. Скорость внешней диффузии будет зависеть от турбулентности (перемешивания) веществ (компонентов) в растворе. Для кофе такое перемешивание создаётся следующими силами:
- помешивание кофе ложкой
- конвективное движение воды от нагревающихся стенок экстрактора (дна и стенок турки)
- движение насыщенного пара из воды на ее поверхность - всплывание воздушных пузырьков, которое мы воспринимаем как слабое кипение.
Подогрев раствора ускоряет процессы растворения и других химических превращений в десятки и сотни раз. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10º скорость большинства реакций увеличивается в 2-4 раза.
Поэтому кофе, залитый во френч-прессе кипятком, заваривается не сильно хуже, чем при длительном подгреве в турке. И именно поэтому основной успех варки кофе в турке лежит между 85 и 95 градусами: научитесь растягивать этот диапазон на 2-4 минуты (в зависимости от ваших вкусовых предпочтений) и вы - МАСТЕР !
2.7. ДОПОЛНЕНИЯ...
Растворение жидкостей.
Взаимная растворимость двух жидкостей определяется тем, насколько сходно строение их молекул («подобное растворяется в подобном»). Для неполярных жидкостей, например углеводородов, характерны слабые межмолекулярные взаимодействия, поэтому молекулы одной жидкости легко проникают между молекулами другой, т.е. жидкости хорошо смешиваются. Напротив, полярные и неполярные жидкости, например вода и углеводороды, смешиваются друг с другом плохо. Каждой молекуле воды нужно сначала вырваться из окружения других таких же молекул, сильно притягивающими ее к себе, и проникнуть между молекулами углеводорода, притягивающими ее слабо. И наоборот, молекулы углеводорода, чтобы раствориться в воде, должны протиснуться между молекулами воды, преодолевая их сильное взаимное притяжение, а для этого нужна энергия. При повышении температуры кинетическая энергия молекул возрастает, межмолекулярное взаимодействие ослабевает и растворимость воды и углеводородов увеличивается. При значительном повышении температуры можно добиться их полной взаимной растворимости. Такую температуру называют верхней критической температурой растворения (ВКТР).
Растворение твердых веществ.
Все твердые вещества проявляют ограниченную растворимость в жидкостях. Их насыщенные растворы имеют при данной температуре определенный состав, который зависит от природы растворенного вещества и растворителя. Так, растворимость хлорида натрия в воде в несколько миллионов раз выше растворимости нафталина в воде, а при растворении их в бензоле наблюдается обратная картина. Этот пример иллюстрирует общее правило, согласно которому твердое вещество легко растворяется в жидкости, имеющей с ним сходные химические и физические свойства, но не растворяется в жидкости с противоположными свойствами.
Соли обычно легко растворяются в воде и хуже – в других полярных растворителях, например в спирте и жидком аммиаке. Однако растворимость солей тоже существенно различается: например, нитрат аммония обладает в миллионы раз большей растворимостью в воде, чем хлорид серебра.
Растворение газов в воде.
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается.
3. Сложные многокомпонентные системы.
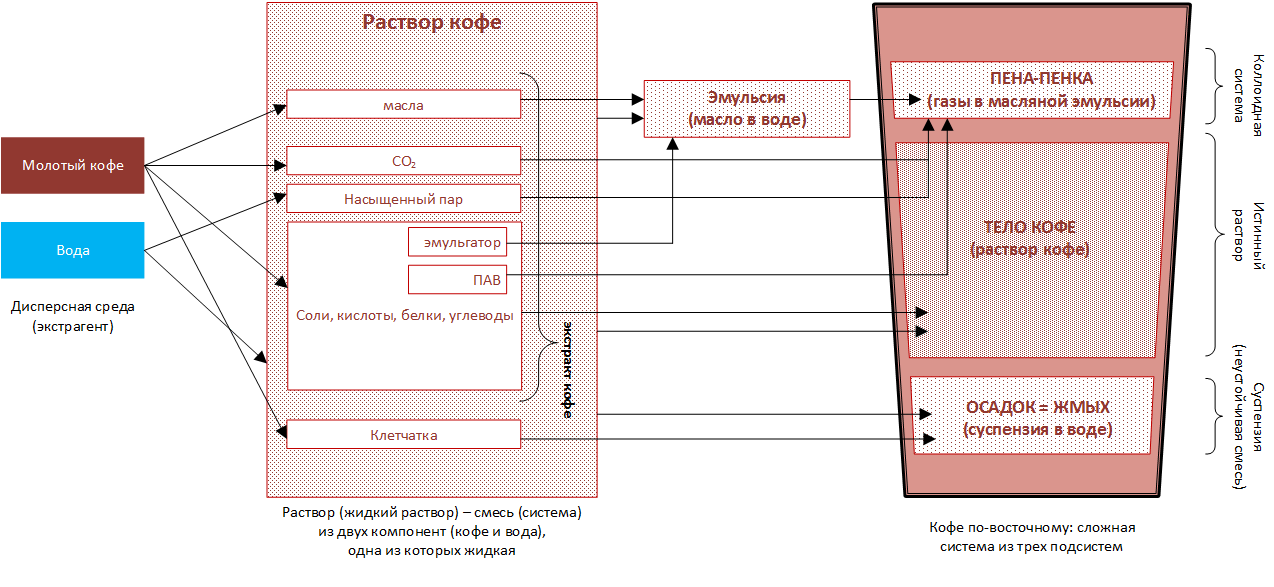
Как было рассмотрено выше, мы представили варку кофе в виде системы "жидкость+твердое тело", где:
а) 1-й однородный компонент системы - это вода (или жидкая фаза, экстрагент)
б) 2-й однородный компонент системы - это кофейные частички (или твердая фаза)
Такое упрощение в целом верно для кофе, как напитка, однако для приготовления кофе методом "по-турецки" твердая фаза не может рассматриваться, как одна фаза (то есть как однородный компонент). Как только частички молотого кофе попадают в воду и смесь нагревается свыше 50 градусов, было бы фатальным для нашего анализа продолжать рассматривать итоговую смесь (раствор) как однородный (или однофазный). По мере нагрева смеси от 50 до 85 градусов, в смеси следует четко выделить такие компоненты, как:
- масла
- углеводы, соли, белки и прочие элементы, которые в сложных системах могут выступать не только формирователями вкуса, но также в качестве эмульгаторов или ПАВ (поверхностноактивных веществ)
- клетчатка
- СО2
- воздух, насыщенный пар
- кислород
- вода
В результате кофе представляет собой не только раствор (раствор кофе - это только тело кофе или 85% напитка), но также и пенку, и осадок (примечание: осадок и пенка не относятся к классу растворов и более-менее четко отделяются от раствора кофе, т.е. имеют явно выраженные границы с ним). В сущности тело кофе, осадок и пенка - это три совершенно разных вида смесей. Давайте их изучим.
Смеси бывают гомогенные и гетерогенные и нечто среднее между ними:
- Гомогенные смеси — это смеси, компоненты которых смешаны на молекулярном уровне. Их называют однофазные смеси. То есть две фазы (компоненты) смешались и образовали одну новую фазу. Это и есть тело кофейного напитка. Но только тело, а не пенка, например.
- Гетерогенные смеси - это смеси, компоненты (фазы) которых полностью не смешаны и эти компоненты существуют в ясно отграниченных фазах. Поэтому их называют многофазными смесями. Бытовые примеры: какао или известь в воде. Если такие смеси оставить на долгое время, то твердая фаза выпадает в осадок. Любой суп или борщ демонстрирует явные элементы гетерогенности, а вот крем-суп - гомогенный, а может даже и коллоид - см следующий абзац.
- Коллоидные смеси (дисперсные системы) - это особый вид смесей, компоненты которых демонстрируют свойства однородности, как у гомогенных смесей, но всё-таки без явного смешения фаз или с неустойчивым смешиванием фаз, как например, пена или туман, исчезающие со временем.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы (например, сплавы, стекло, кварц).
Гетерогенные смеси куда интереснее: жидкое в жидком; газообразное в жидком, твердое в жидком и т.д. Посмотрим таблицу (приводится для общей эрудиции):
| Дисперсная фаза (что) |
Дисперсионная среда (в чем) |
Название и пример |
|---|---|---|
|
Жидкая |
Газообразная |
Аэрозоли: туманы, облака |
|
Твёрдая |
Газообразная |
Аэрозоли (пыли, дымы), порошки |
|
Газообразная |
Жидкая |
Газовые эмульсии и пены, кофейная пенка |
|
Жидкая |
Жидкая |
Эмульсии: нефть, крем, молоко, кофейная пенка |
|
Твёрдая |
Жидкая |
Суспензии и золи: пульпа, ил, взвесь, паста, кофейный осадок |
|
Газообразная |
Твёрдая |
Пористые тела: поролон, пемза |
|
Жидкая |
Твёрдая |
Капиллярные системы: жидкость в пористых телах, грунт, почва |
|
Твёрдая |
Твёрдая |
Твёрдые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы |
Интересно, что из однородной гомогенной смеси можно выделить исходные компоненты, например путем:
- выпаривания
- кристаллизации
- дистилляции
Итак, кофе (точнее сказать - тело кофе или 85% напитка) - это гомогенная смесь под названием РАСТВОР.
Кофейная пенка - это пример коллоидной смеси особого типа: это ПЕНА (или ГАЗ в ЭМУЛЬСИИ).
Кофейный осадок - это СУСПЕНЗИЯ.
3.1. ДИСПЕРСНЫЕ СИСТЕМЫ: суспензии, эмульсии, пены
https://ru.wikipedia.org/wiki/Дисперсная_система
https://ru.wikipedia.org/wiki/Коллоидные_системы
Коллоидные системы находятся посередине между гомогенными и гетерогенными смесями. К этому типу смесей относятся такие смеси, как гели, золи, эмульсии и аэрозоли. Размер частиц в коллоидных системах составляет 1–1000 нм (то есть крупный), в растворах ~0,1 нм (порядка размера молекул). Если коллоидная система имеет жидкое агрегатное состояние, образованное путем примешивания к жидкости (первой компоненте) твердых частичек (вторая компонента), каждая из которых состоит из небольшого числа молекул, то такая система (смесь) ведёт себя как раствор.
В коллоидных растворах очень легко идут процессы агрегации/дезагрегации частиц, их размер увеличивается/уменьшается, соответственно изменяется и осмотическое давление. Коллоидные частицы в растворе подвергаются действию сил тяжести. В грубодисперсных системах, где размеры частиц велики и они малоподвижны (практически нет броуновского движения), силы тяжести приобретают большое значение, приводя к оседанию (редко к всплыванию) частиц ДФ. Это явление называется седиментация. Седиментационное равновесие характеризуется постоянным уменьшением концентрации частиц в направлении от нижних слоев к верхним. Из этого уравнения следует, что с увеличением размеров частиц возрастает и скорость оседания, а с увеличением вязкости наоборот, скорость оседания снижается. Это используют в кулинарной практике, увеличивая вязкость среды и уменьшая размеры частиц тщательным измельчением (например, при изготовлении протертых супов). Практическое применение ускорения седиментации наблюдается в процессе сепарирования молока. Жир, эмульгированный в молоке, под действием центробежной силы концентрируется в виде сливок гораздо быстрее, чем при отстаивании.
Проверить истинность фразы и ее необходимость: Действие силы тяжести в высокодисперсных системах на коллоидные частицы невелико и уравновешивается броуновским движением и диффузией.
Суспе́нзия (от лат. suspensio, подвешивание) — смесь веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе во взвешенном (неосевшем) состоянии. Суспензия — это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой. Обычно частицы дисперсной фазы настолько велики (более 10 мкм), что оседают под действием силы тяжести (седиментируют). Суспензии, в которых седиментация идёт очень медленно из-за малой разницы в плотности дисперсной фазы и дисперсионной среды, иногда называют взвесями. В концентрированных суспензиях легко возникают дисперсные структуры.
Эму́льсия (новолат. emulsio; от лат. emulgeo — дою, выдаиваю) — дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде). Эмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой — вещество, состоящее из слабополярных молекул (например, жидкие углеводороды, жиры). Одна из первых изученных эмульсий — молоко. В нём капли молочного жира распределены в водной среде.
Эмульсии относятся обычно к грубодисперсным системам, поскольку капельки дисперсной фазы имеют размеры от 1 до 50 мкм. Эмульсии низкой концентрации — неструктурированные жидкости. Высококонцентрированные эмульсии — структурированные системы.
Для образования эмульсии недостаточно только перемешивания двух несмешивающихся жидкостей. Если взять чистую воду и маслянистую жидкость, то сколько бы мы их ни перемешивали, эмульсия не образуется. Чтобы она образовалась, необходимо наличие в смеси особых веществ — эмульгаторов. Природные эмульгаторы в том или ином количестве всегда содержатся в воде. К ним относятся соли, асфальтены, смолы, нефтерастворимые органические кислоты и мельчайшие примеси, как ил, глина и др. Понятно, что в кофе такого добра - хоть отбавляй.
Природные эмульгаторы - натуральные стабилизаторы эмульсий, окружающие нас. Их традиционно использовали в качестве компонентов пищевых продуктов, а также в парфюмерии и гигиене. К числу старейших можно отнести желток и белок жидкого яйца. В кофе также содержится не менее 10% белков. Белки кофе - альбумины - простые растворимые в воде белки, умеренно растворимые в концентрированных растворах соли и свёртывающиеся при нагревании (денатурация белка). Многие семена растений содержат альбумины.
Современная промышленность использует в качестве эмульгаторов в основном синтетические вещества, а также лецитин (преимущественно соевый).
 Таким образом, при наличии эмульгатора мы могли бы получить эмульсию (устойчивую взвесь масла в воде) и различные добавки в кофе могут этому содействовать, например, смола мастикового дерева. Однако если эмульгатора нет, жир, как ему и положено, всплывает вверх и далее под напором горячего пара кипящей воды распадается на жирные кислоты, часть которых испаряется, а часть растворяется в напитке, придавая ему "технический" вкус.
Таким образом, при наличии эмульгатора мы могли бы получить эмульсию (устойчивую взвесь масла в воде) и различные добавки в кофе могут этому содействовать, например, смола мастикового дерева. Однако если эмульгатора нет, жир, как ему и положено, всплывает вверх и далее под напором горячего пара кипящей воды распадается на жирные кислоты, часть которых испаряется, а часть растворяется в напитке, придавая ему "технический" вкус.
Пена — взвесь газа в жидкости (или в твёрдом теле). Ключевым фактором для образования пены является наличие ПАВ (поверхносто-активных веществ).
https://en.wikipedia.org/wiki/Surfactant
Так что же представляет собой кофейная пенка? - Это дисперсная система: газ (CO2) в жидкости, где жидкостью выступает жир (масло), природные ПАВ и природные эмульгаторы. CO2 в O/W - это углекислый газ в oil-in-water emulsion.
Что нам необходимо вынести из этого для варки кофе? Жиры выделяются из кофейных частичек и всплывают на поверхность, так как обладают меньшей плотностью чем вода. В присутствии природных эмульгаторов жиры вместе с водой образуют эмульсию, что мы и видим на поверхности воды. По мере проникновения в эту эмульсию СО2, выделяющегося из кофейных зерен (CO2 в зернах накапливается еще при жарке и потому зерна не стоит молоть до самого последнего момента), растворенного в воде воздуха, кислорода и насыщенных паров самой воды, на поверхности образуется пенка - мелкие пузырьки пара/воздуха и СО2, застрявшие в эмульсии. Сохранению этих пенных пузырьков в течение многих минут содействуют ПАВ (сурфактанты), снижающие поверхностное натяжение в пене. В результате мы и получаем это ценное состояние жиров (в виде пенной эмульсии), которое должно быть сохранено до самой чашки.

Фото В.Рудь.
Из этого следует понимание как механизма образования пенки, так и механизмов ее разрушения в ходе воздушно-пузырьковой барборации, возникающей на последних фазах кипения. О выделении жиров и их распаде см. следующий раздел.
Часто получается что в кофейно пенке застревают взвешенные частицы кофе, бывает также, что они плавают и в основном растворе. Частички плавают, потому что кофе в турке варили недостаточно долго и адсорбированный ими воздух не весь отделился. Или варили кофе долго, но плохо его помешивали. Если же помол кофе был крупным, то надо увеличивать стадию набухания кофе перед его варкой.
3.2. О САХАРЕ И СОЛИ В КОТОРЫЙ РАЗ
Не проверенные сведения (или гипотезы):
- сахар и соль повышают экстрактивные свойства воды, как растворителя, а именно сахар повышает кислотность среды (растворителя) и тем самым улучшает гидратацию растворимого вещеста и его выход из твердой фазы в раствор. Хотя... активность сладкой воды сама по себе видимо ниже, чем активность чистой воды, где активность - это вспомогательная расчетная термодинамическая функция, которая характеризует степень связанности молекул компонента;
- сахар и соль повышают активность отдельных ферментов;
- сахар и соль уменьшают выход горьких и ароматических веществ из клеточных оболочек (из клетчатки);
- сахар и соль улучшают коагуляцию белков при кипячении.
Известно:
- соль нейтрализует (забивает) горечь или просто смягчает резкие вкусы;
- сахар оседает на дно турки и тем самым снижает интенсивность бурления воды при кипении (хотя же ж всё зависит от того, откуда идет нагрев и какова его мощность);
- сахар повышает поверхностное натяжение воды. В результате кофейная пенка в сладкой воде будет более устойчивой.
4. Расщепление липидов
Внимание: не законченный раздел.
Липи́ды (от греч. λίπος, lípos — жир) — обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот. Если липиды - это в сущности жиры, то следует знать, что растительные жиры обычно называют маслами.
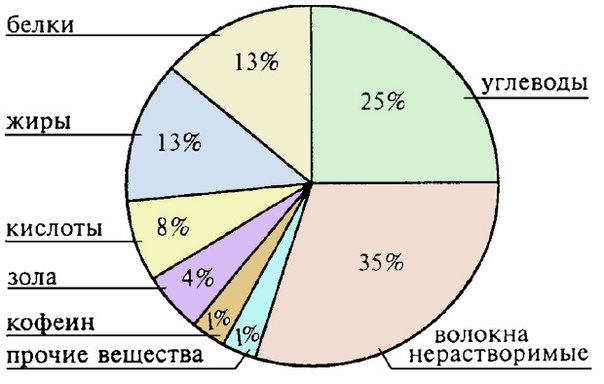
Расщепление липидов: как экстрагировать масла (да и белки) и не разрушить их после экстракции. Ведь именно они обеспечивают органолептическое восприятие напитка, как впрочем и любой другой пищи. Сколько же этого добра в кофе? Смотрим диаграмму ниже. Более 20% кофейных ингредиентов требуют профессиональных кулинарных знаний (!) и мастерства для их правильной экстракции. К ним относятся белки, жиры и кислоты. Малейшая ошибка и вместо экстракции вы получаете гидролиз ценных веществ до жирных кислот со вкусом прошлогоднего масла на вашей даче.
Растворимость липидов (жиров и масел, что впрочем одно и тоже) в воде равна нулю. При температуре до 100 С они практически не растворяются. Однако выделяющиеся при их расщеплении жирные кислоты в той или иной степени могут растворяться в воде и при кипячении улетучиваться с паром. При высокой температуре под высоким давлением растворимость жиров в воде значительно повышается, что называют омылением жиров (вид гидролиза). Таким образом, варим мы вроде как кофе, но есть шанс сварить мыло :)
Растворы жиров имеют кислую реакцию. Жиры не растворимы в воде, но в присутствии белковых, слизистых или некоторых других веществ, называемых эмульгаторами, способны образовывать с водой стойкие эмульсии.
Жиры способны растворять некоторые ароматические вещества.
При нагревании до 200 градусов жиры разрушаются с выделением свободных жирных кислот и различных смолообразных продуктов и их полимеризации. В сущности, жиры и есть эти кислоты в неком связанном состоянии. Распад жиров до кислот в чистом виде зависит зависит лишь от температуры нагрева: одни жиры распадаются раньше (при 100 градусах), иные - позже, при 300 градусах.
4.1. О ФОРМИРОВАНИИ ВКУСА КОФЕ
Послевкусие - как оно формируется...
5. Всё, что нужно знать о кипении
Понимание кипения - ключевой аспект в понимании процесса варения кофе. Сложная термогидродинамика кипения жидкостей и растворов оказывает существенное влияние на изменение вкусовых характеристик растворенных веществ.
Кипение - это переход жидкости в пар - фазовый переход воды из одного (жидкого) состояния в другое - газообразное. Нам важно понимать все стадии кипения: от образования в толще воды структурных элементов паровой фазы - "паровых пузырьков" - и до разрыва паровых пузырей на поверхности воды: пар вырывается из пузыря, резко разбрасывая воду в стороны (брызги и бульки).
Температура, при которой происходит кипение жидкости, находящейся под постоянным давлением (напр., атмосферным), наз. температурой кипения (Ткип). В качестве Tкип принимают температуру насыщенного пара (температуру насыщения) над плоской поверхностью жидкости, кипящей при данном давлении. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества. С возрастанием давления Ткип увеличивается. С падением - уменьшается. Вот почему в горах вода кипит, но сварить в ней яйца нет возможности - вода не достигает 100 градусов и выпаривается...
Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Температура кипения чистой воды при нормальном атмосферном давлении (101,3 кПа) равна 100° С. При стационарном кипении температура кипящей жидкости не меняется.
Если растворить в воде какое-нибудь твердое вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100° С. Так температура кипения раствора, содержащего 1 моль растворенного (недиссоциирующего) вещества в 1000 г воды, составляет уже 100,52° независимо от природы этого вещества.
Если же вещество диссоциирует, образуя ионы, то температура кипения увеличивается пропорционально росту общего числа частиц растворенного вещества, которое благодаря диссоциации превышает число молекул вещества, добавленных в раствор. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя.
Впрочем всё это не имеет для кофе в турке существенного значения: можно ожидать повышения температуры кипения раствора кофе в воде всего на 1-2 градуса. Но дело не градусах. Идеально было бы сварить кофе в автоклаве при повышенном давлении, то есть когда вода достигнет 110-120° С, но всё еще не будет кипеть.
==== врезка ===============
Если рассматривать растворы нелетучего вещества в летучих растворителях, то температура кипения таких растворов всегда выше температуры кипения чистого растворителя. Повышение температуры кипения будет тем больше, чем выше концентрация раствора. И для разбавленных растворов его можно считать пропорциональным концентрации. Для растворов температуры кипения являются более высокими, чем для чистого растворителя и разность между ними будет тем большей, чем выше концентрация растворов. Повышение температуры кипения пропорционально концентрации раствора.
==== конце врезки ==========
Для поддержания кипения к жидкости необходимо подводить теплоту, которая расходуется на парообразование и работу пара против внешнего давления при увеличении объёма паровой фазы. Большая часть энергии идет на разрыв связей между молекулами воды. Таким образом, кипение неразрывно связано с теплообменом, вследствие которого от поверхности нагрева (дна турки) к жидкости передаётся теплота.
В кипящей жидкости устанавливается определённое распределение температуры — у поверхности нагрева жидкость заметно перегрета. Величина перегрева зависит от ряда физико-химических свойств как самой жидкости, так и граничных твёрдых поверхностей.
Возможность значительного перегрева чистой жидкости без кипения объясняется затрудненностью возникновения начальных маленьких пузырьков, их образованию мешает значительное взаимное притяжение молекул жидкости. Иначе обстоит дело, когда жидкость содержит растворенные газы и различные мельчайшие взвешенные частицы. В этом случае уже незначительный перегрев (на десятые доли градуса) вызывает устойчивое и спокойное кипение, так как начальными зародышами паровой фазы служат газовые пузырьки и твердые частицы. Основные центры парообразования находятся в точках нагреваемой поверхности, где имеются мельчайшие поры с адсорбированным газом, а также различные неоднородности, включения и налеты, снижающие молекулярное сцепление жидкости с поверхностью.
Различают объемное и поверхностное кипение. Объемное кипение - образование паровых пузырей внутри массы жидкости, находящейся в перегретом, или метастабильном, состоянии при Тж>Ткип, где Тж - температура перегретой жидкости. Такое кипение встречается очень редко.
Поверхностное кипение - парообразование на поверхности нагрева, имеющей температуру Тн>Ткип. Такое кипение возможно и в случае, когда температура основной массы жидкости Тж<Ткип, но в окрестности поверхности нагрева образовался пограничный слой, перегретый до температуры, превышающей Ткип. Основные виды поверхностного кипение - пузырьковое и пленочное.
Пленочное кипение мы не рассматриваем, так как оно не проявляется в кулинарии. Однако нечто похожее можно наблюдать у турок кастрюлевидной формы, когда вода закипает в них вдоль стенок. Поэтому лучше иметь турку, форма которой слегка конусовидная или луковичная. Это важно преимущественно для газовых плит, где перегрев стенки случается достаточно просто. На песке в силу плавности нагрева пристеночное кипение, как правило, не наблюдается.
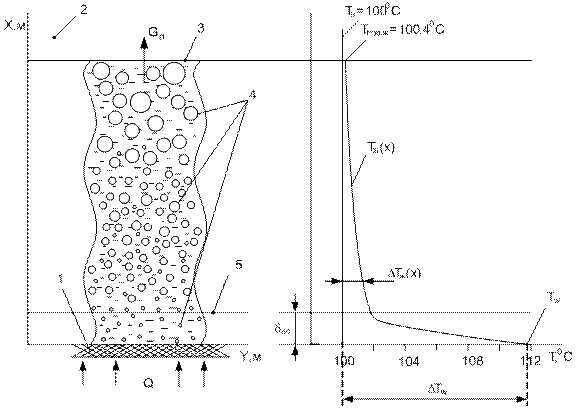 Пузырьковое кипение (это как раз наш, кофейный случай) возникает при умеренных тепловых потоках на микровпадинах поверхности, смачиваемой водой (жидкостью). Пар генерируется на действующих центрах парообразования в виде цепочек пузырей. Благодаря циркуляции жидкости, непосредственно контактирующей с поверхностью нагрева, обеспечивается высокая интенсивность теплоотдачи.
Пузырьковое кипение (это как раз наш, кофейный случай) возникает при умеренных тепловых потоках на микровпадинах поверхности, смачиваемой водой (жидкостью). Пар генерируется на действующих центрах парообразования в виде цепочек пузырей. Благодаря циркуляции жидкости, непосредственно контактирующей с поверхностью нагрева, обеспечивается высокая интенсивность теплоотдачи.
- пузырьковое кипение начинается с зарождения в толще (объеме) воды структурных элементов [новой фазы]: паровых пузырьков и далее паровых струй;
- пузырьковое кипение заканчивается на границе раздела жидкости и пара (т.е. на поверхности воды) путем выброса пара из лопающегося парового пузыря (бульки).
Комментарий к рисунку (по материалам https://studopedia.ru):
А (слева) – картина процесса кипения; B (справа) – распределение температуры;
1 – поверхность теплообмена (стенка); 2 – насыщенный водяной пар;
3 – поверхность воды; 4 – всплывающие паровые пузыри;
5 – внешняя граница пограничного слоя;
Tпов.ж – температура поверхности жидкости;
Tw – температура поверхности теплообмена (стенки);
Tн – температура насыщения жидкости при заданном давлении;
pн – давление насыщения; δпс – толщина пограничного слоя;
Q – тепловой поток от стенки к воде; Gп – массовый расход пара
Нам важно понимать все стадии кипения. Рассмотрим их. Стадии выделяются исходя из физических представлений о процессе кипения и возможностях наблюдать их визуально в бытовых условиях. Все временные параметры даны для турок 150-300 мл с подогревом на наименьшей конфорке, включенной на половину своей мощности.
1. Заливаем воду в турку и начинаем нагревать. Засыпаем кофе. С нагреванием растворенный в воде воздух и газы (СО2, кислород) расширяются и выделяются на порах и микротрещинах стенок турки, которые служат центрами зарождения едва видных пузырьков. При заливке воды в сухую турку эти поры могут содержать не вытесненный воздух: поверхностное натяжение не даёт воде залить эти поры. Мелкие пузырьки могут выделяться также на кофейных частичках. У них две природы: кофейная частица захватила часть воздуха в момент засыпки кофе в воду, а также кофейная частица могла выделить СО2, накопленный в кофейных зернах в ходе их обжарки.
2. Воздушные пузырьки множатся в количестве и покрывают все горячие поверхности турки. Некоторые пузырьки отрываются от мест своего образования и всплывают. Частички кофе, обросшие своими микропузырьками, всплывают на поверхность и образуют там нежелательную шапку.
3. Пузырьки растут, увеливаясь в размерах до 1-2 мм (ну типа "рыбий глаз"). Растут вследствие того, что воздух внутри них расширяется, а также за счет слияния соседних пузырьков. В какой-то момент времени пузырек становится настолько крупным (достигает отрывного диаметра), что архимедовой силой его начинает отрывать от стенки турки (от места зарождения) и выносить вверх, на поверхность. Не все пузырьки и не сразу устремляются к поверхности. Ото дна способны оторваться те пузырьки, у которых достигается определенное соотношения размера и формы. Форма пузырьков на дне определяется смачиваемостью дна сосуда. Как известно, она характеризуется краевым углом смачивания (и связанной с ним силой поверхностного натяжения жидкости), а также неким притяжением пузырей к поверхности нагрева. Нонятно, что постоянство величины угла смачивания и неоднородность (царапины) поверхности дна турки приводят к тому, что на каждом квадратном сантиметре турки может быть особая ситуация для парообразования. Величина поверхностного натяжения и краевой угол смачивания определяют величину адгезии жидкости к твердой поверхности. Чем она выше, тем сложнее пузырьку оторваться ото дна. К росту размера пузырьков на дне турки приводят также слияния соседних пузырьков на дне турки.
Пузырьки всплывают на поверхность и их содержимое переходит в паровую фазу над жидкостью. Но если на поверхности уже возникла масляная пленка (эмульсия), то пузырьки формируют пену.
4. По мере перегрева стенок турки и нижних слоев жидкости вода начинает испаряться внутрь пузырьков и вызывает их дополнительное увеличение. Пузырьки теперь растут вследствие того, что пар внутри них накапливается и расширяется. Эту стадию иногда называют "крабий глаз", видимо потому, что у крабов глаза больше, чем у рыб :)
Паровые пузырьки зарождаются и сами собой в различных микротрещинах и царапинах дна турки.
Радиус межфазной поверхности пузырька – зародыша пропорционален размеру образующей его микрошероховатости на поверхности стенки. Поэтому в начале пузырькового режима кипения, при незначительном перегреве жидкости, "работают" лишь крупные центры парообразования, так как у мелких центров парообразования пузырьки-зародыши имеют радиус меньше критического (сила их натяжения превосходит силу расширения). Количество центров парообразования растет медленно, так как существенная часть тепла отводится от поверхности нагрева конвекцией. Поэтому сначала происходит неустойчивое или слаборазвитое пузырьковое кипение.
С увеличением перегрева жидкости активизируются более мелкие центры парообразования, поэтому количество образующихся пузырьков и частота их отрыва возрастают. В результате интенсивность теплоотдачи от стенки турки в раствор чрезвычайно быстро увеличивается.
Стадии 3 и 4 происходят в диапазоне примерно с 50 градусов до 80 градусов и сопровождаются гулом. Гул формируется за счет вибрации поверхности наиболее крупных паровых и воздушных пузырьков, не оторвавшихся еще ото дна турки. Поверхность вибрируют за счет того, что внутри пузырька происходит расширение его содержимого, а упругие силы поверхностного натяжения воды пытаются сжать пузырек и даже прихлопнуть его ко дну турки. В результате возникают колебания и связанные с ними звуковые волны.
На стадиях 3 и 4 начинается заметная конвекция: нагреваясь вблизи дна, вода расширяется. Соответственно, удельный вес придонной разогретой воды оказывается легче, чем вес равного объема воды в поверхностных слоях. Это приводит всю водную систему внутри турки в нестабильное состояние, которое компенсируется за счет того, что горячая вода начинает всплывать к поверхности, а на ее место опускается более прохладная вода. Это свободная конвекция. При вынужденной конвекции теплообмен создается с помощь перемешивания жидкости, например, ложкой.
5. Количество пузырьков (причем из мелких центров парообразования) нарастает, а также нарастает скорость их фомирования и отрыва. Начиная с 70 градусов все паровые и воздушные, и паро-воздушные пузырьки массово отрываются от горячего дна и стенок сосуда и устремляются вверх, к поверхности. В результате пузырьки образовывают длинные струи - почти непрерывные потоки пузырьков, тянущиеся от дна к поверхности. Часть пузырьков долетает до верха, часть не долетает, но главное - они остаются мелкими и не успевают вырасти в диаметре, так как верхние слои еще пока холоднее нижних, что и приводит к снижению диаметра паровых пузырей или даже к их исчезновению (исчезновение пузырьков или их схлапывание создаёт звуковую волну, воспринимаемую нами как шум). Такое массовое насыщение воды мелкими паровыми пузырями с исчезающе малыми диаметрами визуально воспринимается как побеление или помутнее воды и сопровождается ее шумом, как было указано выше (примечание: шумом, но не гулом). Вода будет шуметь (мелко вибрировать) пока верхний слой не прогреется за счет конвективного и турбулентного перемешивания слоёв жидкости. Это происходит достаточно быстро, как правило в чайнике это происходит за 5-15 секунд, если количество подводимого тепла не будет уменьшено. Это также зависит от высоты сосуда: чем он выше, тем больше верхний слой жидкости отличается по температуре от нижних и тем медленее происходит выравнивание температур. По этой причине (если вы ее хорошо понимаете), высокие турки лучше низких.
Примечание 1: гул снижается на стадии 5, так как пузырьки больше не вибрируют в ходе своего расширения, а быстро отрываются от контактной поверхности нагрева и устремляются вверх.
Примечание 2: шум не будет наблюдаться, если посудина низкая и разность температуры в верхних и нижних слоях слоях ничтожно мала. Эта низкая разность может быть достигнута и за счет равномерного и медленного нагрева, как например, в полукруглых казанах.
6. Образование пузырьков по всей площади поверхности турки продолжается до тех пор, пока температура стенок турки достаточна для образования паровых пузырьков в пристеночных, но преимущественно в придонных (перегретых) областях сосуда. Для формирования паровых пузырьков требуется:
- а) перегретые участки дна и стенок турки (перегрев возникает из-за неровностей самой турки, микродефектов внутри дна и стенок, неравномерности обогрева дна и стенок пламенем горелки)
- б) шероховатости поверхности (трещины, царапины, микровпадины), где поверхностное натяжение воды слабее и это облегчает зарождение парового пузырька именно в этом месте (при данной температуре), а не в каком-то другом.
Паровые пузырьки начинают всё быстрее и быстрее расти в диаметре по мере подъема со дна турки к поверхности напитка и образуют длинные нити, тянующиеся от дна турки (от наиболее горячих участков поверхности турки) до самой поверхности напитка. Нити постепенно утолщаются, так как расширяющиеся пузырьки набегают друг на друга, сливаются и укрупняются.
7. Турбулентный поток жидкости начинает преобладать над конвективным:
- на этой стадии горячие потоки воды от нагретого дна турки движутся вверх подобно слабым родниковым ключам, создавая не просто перемещение слоёв, а поток (поверхность воды заметно шевелится или слегка волнуется).
- турбулентный поток пузырей тащит за собой горячую воду вверх.
Эти два потока играют важную и полезную роль для кофе: они перемешивают систему "кофе+вода", облегчая труд нерадивых кофеманов, которые еще поплатятся за свою лень... Частички кофе в это время как бы пляшут, подбрасываемые снизу паровыми пузырьками, и увлекаются вверх током воды, формируя кофейную шапку из твердой фазы, еще не отдавшей все свои растворимые вещества в раствор. Радивые кофеманы в это время перемешиват кофе ложкой в направлении сверху вниз (в противотоке) и следят за тем, чтобы стадия 7 была последней для их напитка, но наиболее длинной: если в этот момент ослабить нагрев, то конвективный поток будет преобладать над турбулентным (турбулентный может ослабнуть совсем) и вода плавно дойдет до 98 градусов без внешних признаков кипения.
Нам как раз и нужна эта плавность: рост температуры без бурления. Такое кипячение называется "кипячение с недогревом" или конвективным кипением: то есть температура пара внутри пузырьков еле-еле достигает температуры насыщения. Однако если нагрев не снизить, то вода переходит в нежелательную для нас стадию 8.
Преобладание турбулентного потока над ковективным называют кипением с развитым характером. Еще раз подчеркиваем, что это для кофе вредно. Вредно не только потому, что еще немного и набегающие пузыри превратятся в бульки и разрушат пену. Но и потому, что без бурления температура под шапкой будет на 2-3 градуса ниже температуры средних слоев турки, что позволит уберечь масляную пенку от ненужного ей перегрева. Однако следите, чтобы в пенке не было крупных частиц кофе, которые так и не смогли намокнуть и экстрагировать своё содержимое. Если вы не избавитесь от них щадящим помешиванием, то они будут скрипеть у вас на зубах и липнуть к губам. За это некторые (да впрочем - все) и не любят "кофе по-восточному" !
8. По мере прогрева верхнего слоя вода у дна турки будет иметь температуру уже около 110 градусов. Это перегретая вода. В результате этого:
- число нитей очень быстро сокращается, можно сказать они сливаются в несколько пучков кипения
- пузырьки расширяются вдоль всей траектории своего пути вверх и сливаются в пучах кипения все ниже и ниже, так что возникает визуальное впечатление, что крупные пузырьки идут уже с самого дна.
- до поверхности воды долетают уже не пузырьки, а пузыри (бульки) диаметром 0,5 см и больше (зависит от высоты турки и силы нагрева), которые на поверхности разрываются с силой расширяющегося пара и расплескивают воду вокруг горла турки.
Жидкость начинает бурлить, а кофейная пенка крупно пузыриться и стремительно подниматься. Кофе начинает погибать от разрушающихся компонентов пены.
Стадия 8, в зависимости от мощности нагрева плиты, начинается в диапазоне с 93 до 97 градусов (это средняя температура раствора, так как придонная часть уже однозначно перегрета). Наша задача - ослабить нагрев плиты таким образом, чтобы температура напитка не поднялась выше 95 градусов. Желательно вообще не допускать стадия 8. Если этого не сделать, то бульки силой своего пара начинают рвать жировую пенку на поверхности кофе, разрушая жиры до жирных кислот с неприятным вкусом и запахом. Это и есть главная ошибка и главная неудача в варке кофе.
9. Паровые пузыри долетают до поверхности и лопаются на ней. Так возникают бульки. На поверхности воды пар вырывается из пузыря, резко разбрасывая воду в стороны (брызги). Вода булькает. Кофе "умер".
10. Над водой начинает клубиться небольшое паровое облако. Кофе издох...
О правильном кипячении воды для кофе. Для правильного подогрева кофейного порошка с водой надо установить такой нагрев плиты, чтобы Ваша турка со всем ее содержимым без дополнительных регулировок с вашей стороны "прошла" свой путь от 70 до 95 градусов за время около 4-5 минут. Что происходит за эти 4-5 минут?
За эти 4 минуты вода проходит стадии 3 - 7, причем стадии 6 и 7 вы пролонгируете максимально и убираете кофе с плиты. Разрешается подлить холодной воды в кофе при наличии признаков стадии 8 (кстати, это совет подсмотрен у мадам Молоховец).
Таким образом, крайне важно не прозевать переход напитка от стадии 7 к стадии 8. Стадии 6 и 7 должны быть максимально растянуты во времени, кофе даже убежать не сможет, ему не хватит энергии, даваемой от плиты. Да и само кипение (булькание), если случится, будем весьма плавным и не разрушительным для вашего напитка. Это будет даже не кипение, а волнение жидкости: более горячие нижние слои воды будут интенсивно двигаться вверх. И это то, что нужно. Ибо главное - это избегать парового бурления жидкости. Любое интенсивное ВОЛНЕНИЕ жидкости за счет ее конвективных потоков будет в разы лучше, чем БУРЛЕНИЕ. Поэтому для кофе даже 100 градусов могут быть не страшными.
Варка кофе в кипяченой воде.
Какая вода закипает быстрее: свежая или ранее кипяченая? Ответ: быстрее забурлит свежая, так как в ней больше растворенного воздуха. По этой причине существуют методы варки кофе из кипяченой или даже только-только закипевшей воды (кстати кипяченая вода, как правило, обеднена кислородом).
Например, кипятят воду в турке, можно с сахаром. Снимают воду с плиты и добавляют в нее кофе. После этого добавляют немного холодной воды и доводят смесь до кипения. Очевидно, что таким образом можно понизить риск булькания кофе и тем самым сохранить ценную пенку в полной сохранности.
Примечание по испарению. При испарении жидкость покидают молекулы, которые обладают достаточной кинетической энергией, чтобы преодолеть силы сцепления между молекулами и совершить работу выхода из жидкости. Испарение происходит при любой температуре, т.к. при любой температуре в жидкости находятся такие молекулы. Испарение происходит только с поверхности жидкости.
Сложная термогидродинамика кипения жидкостей и растворов оказывает существенное влияние на изменение вкусовых характеристик растворенных веществ.
Работа, затрачиваемая на увеличение объема и поверхностной энергии сферического пузыря радиуса R, определяется по формуле: L0=-(4/3)pR3Dp+4pЛ2s, где Dp - разность давлений в пузыре и окружающей жидкости, Па; s - коэффициент поверхностного натяжения, Н/м. Минимальный радиус возникающего парового пузыря (зародыша) Rмин=2Ткипs/[rrп(Тж-Tкип)], где rп - плотность пара, кг/м3; r - теплота парообразования, Дж/кг, Тж-текущая температура жидкости и Ткип =100º С. Местами, в которых возникают зародыши паровой фазы, могут служить газообразные включения, твердые частицы, находящиеся в жидкости, микровпадины на поверхностях нагрева и др.
Работа, необходимая для образования парового "пятна" на стенке и границы раздела пар - жидкость: L=L0(0,5+0,75cosQ-0,25cos3Q), где Q - краевой угол смачивания. При Q=180° работа L=0, т.е. на абсолютно смачиваемой поверхности образуется сферический пузырь, как и в объеме жидкости.
С понижением температуры конфорки замедляется процесс образования паровых зародышей и поверхность нагрева обедняется центрами генерации паровых пузырей. Это приводит к нестабильному кипению, при котором происходит конвективное движение перегретой жидкости, сменяемое бурным вскипанием, инициированным одной или несколькими микровпадинами подходящего радиуса. С понижением температуры при вскипании жидкости эти микровпадины "выключаются" и снова повторяется цикл перегрева движущейся конвективно жидкости.

